コンテンツ
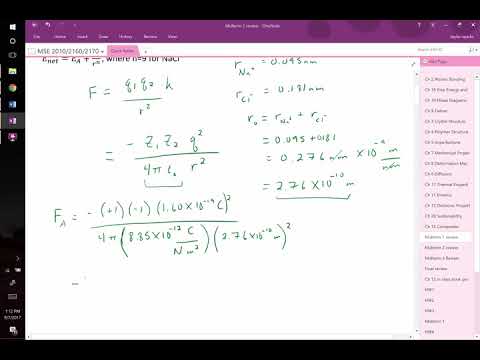
金属と非金属が化合物を形成するとき、金属原子は非金属原子に電子を供与します。金属原子は負に帯電した電子の損失により正イオンになり、非金属原子は負イオンになります。イオンは反対の電荷のイオンに対して引力を示します。したがって、「反対のイオンが引き付ける」という格言です。反対に帯電したイオン間の引力はクーロンの法則に従います:F = k * q1 * q2 / d2、ここでFはニュートンの引力、q1 およびq2 は2つのイオンの電荷をクーロンで表し、dはイオンの原子核間の距離をメートルで表し、kは8.99 x 10の比例定数です。9 ニュートン平方メートル/平方クーロン。
イオンの表を参照して、化合物中の正および負イオンの電荷を見つけます。慣例により、化学式は最初に陽イオンをリストします。化合物中の臭化カルシウム、またはCaBr2、たとえば、カルシウムは正イオンを表し、+ 2の電荷を示します。臭素はマイナスイオンを表し、-1の電荷を示します。したがって、q1 = 2およびq2 = 1クーロンの法則方程式。
各電荷に1.9 x 10を掛けて、イオンの電荷をクーロンに変換します-19。したがって、+ 2カルシウムイオンは、2 * 1.9 x 10の電荷を示します。-19 = 3.8 x 10-19 クーロン、臭素は1.9 x 10の電荷を示します-19 クーロン。
イオン半径の表を参照して、イオン間の距離を決定します。それらが固体を形成するとき、通常、イオンは可能な限り互いに近くに座っています。それらの間の距離は、正イオンと負イオンの半径を足し合わせることで求められます。例では、臭化カルシウム、Ca2+ イオンは約1.00オングストロームの半径を示し、Br-イオンは約1.96オングストロームの半径を示します。したがって、核間の距離は1.00 + 1.96 = 3.96オングストロームです。
オングストロームの値に1 x 10を掛けて、イオンの原子核間の距離をメートルの単位に変換します-10。前の例を続けると、3.96オングストロームの距離は3.96 x 10に変換されます-10 メートル。
F = k * qに従って引力を計算する1 * q2 / d2.
以前に取得した臭化カルシウムの値と8.99 x 10を使用して9 kの値はF =(8.99 x 109)*(3.8 x 10-19)*(1.9 x 10-19)/(3.96 x 10-10)2。科学的な操作順序の規則では、距離の2乗を最初に実行する必要があります。これにより、F =(8.99 x 109)*(3.8 x 10-19)*(1.9 x 10-19)/(1.57 x 10-19)。乗算と除算を実行すると、F = 4.1 x 10が得られます-9 ニュートン。この値は、イオン間の引力を表します。